无机酸和碱。pKa值
无机酸和碱以及水合金属离子的酸解离常数pKa的负对数值。
定义的酸解离常数而且pK一个下表所示。
pK一个表中给出的值是在25°C下测量的,除非在pKa值处用上标表示其他温度(°C)。
另请参阅含酸碱离子的盐水溶液的酸碱性质,缓冲区的解决方案,胺、二胺和环有机氮化合物的pKa,苯酚、醇和羧酸的pKa而且酸碱pH指标
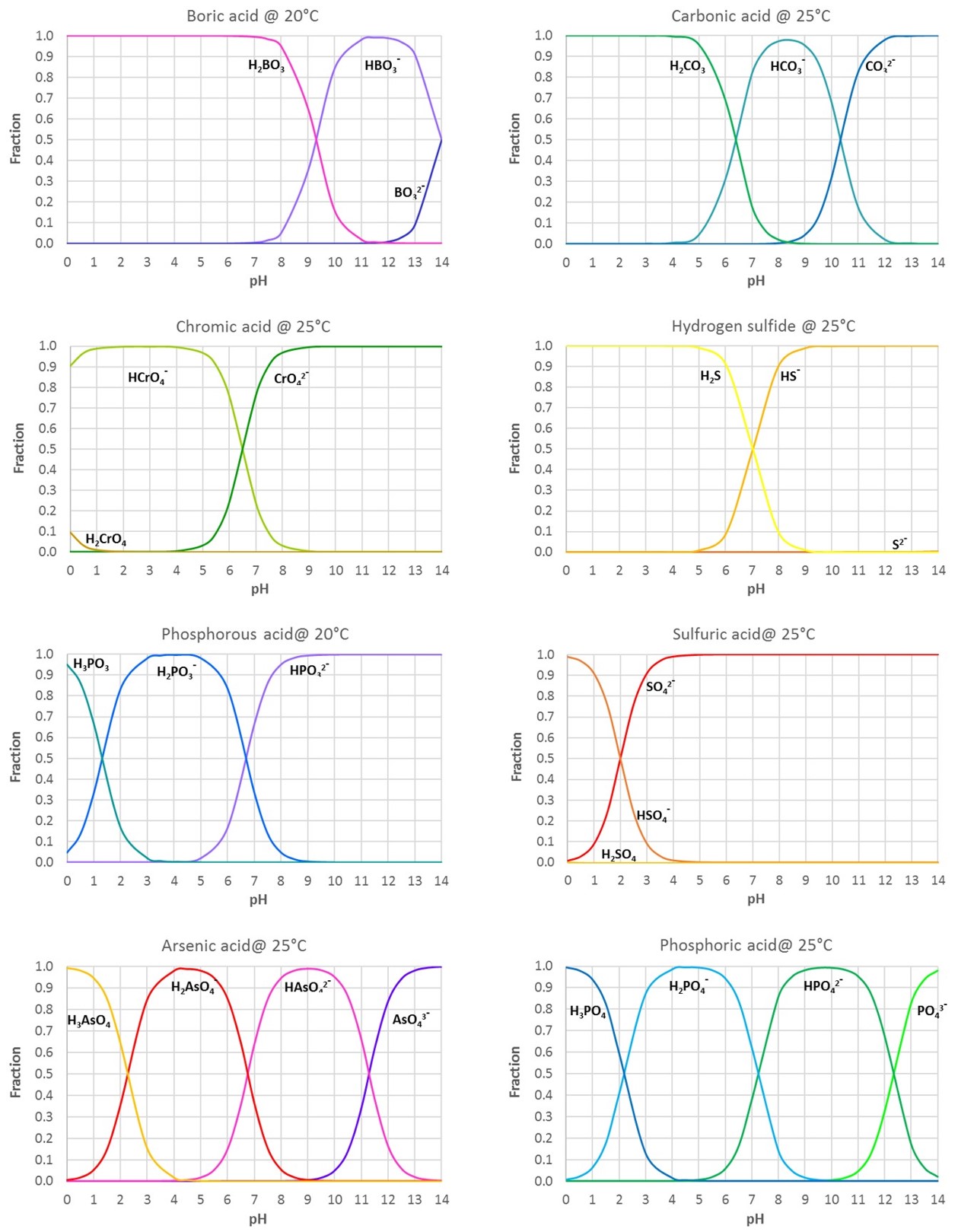
在桌子下面,图中显示了不同pH值下水溶液中不同酸形式的分数给出了一些常见酸(从表pK一个年代)。
NB !对于碱,解离常数用pK表示一个值的共轭酸,BH+.这些值用*标记。
| 酸的名字 | 公式 | pKa1 | pKa2 | pKa3 | pKa4 |
| Monoprotic酸 | |||||
| 氨 | NH3. | 9.24 * | |||
| 砷酸 | H3.麻生太郎3. | 9.29 | |||
| 硼酸 | H3.薄3. | 9.24 | |||
| 亚氯酸 | HClO2 | 1.94 | |||
| 氰酸 | HOCN | 3.46 | |||
| 叠氮酸 | 接下来的3. | 4.72 | |||
| 联氨 | N2H4 | 8.1 * | |||
| 氢溴酸 | 哈佛商业评论 | 9 | |||
| 盐酸 | 盐酸 | 7 | |||
| 氢氰酸 | HCN | 9.21 | |||
| 氢氟酸 | 高频 | 3.17 | |||
| 氢碘酸 | 嗨 | -10 | |||
| 过氧化氢 | H2O2 | 11.65 | |||
| 羟胺 | H2能剧 | 5.94 | |||
| 次溴酸 | HOBr | 8.62 | |||
| 次氯酸 | HOCl | 7.54 | |||
| Hypoiodous酸 | 海 | 10.64 | |||
| 次磷酸 | H3.阿宝2 | 1.23 | |||
| 碘的酸 | HIO3. | 0.78 | |||
| 亚硝酸 | HNO2 | 3.25 | |||
| 硝酸 | HNO3. | -1.37 | |||
| 高氯酸 | HClO4 | -1.620. | |||
| 高碘酸 | HIO4 | 1.64 | |||
| 氨基磺酸 | H2太阳亮度3.H | 1.05 | |||
| Tetrafluoroboric酸 | 住宅4 | 0.5 | |||
| 硫氰酸 | HSCN | -1.8 | |||
| 水 | H2O | 13.995 | |||
| Diprotic酸 | |||||
| 硼酸 | H3.薄3. | 9.2720. | 1420. | ||
| 碳酸 | H2有限公司3. | 6.35 | 10.33 | ||
| 铬酸 | H2阴极射线示波器4 | -0.98 | 6.49 | ||
| 日耳曼酸 | H2地理3. | 9.01 | 12.3 | ||
| 硒化氢 | H2Se | 3.89 | 11.0 | ||
| 硫化氢 | H2年代 | 7.02 | 19 | ||
| 碲化氢 | H2Te | 2.618 | 11 | ||
| 磷酸 | H3.阿宝3. | 1.320. | 6.720. | ||
| 亚硒酸 | H2搜索引擎优化3. | 2.62 | 8.32 | ||
| 硒酸 | H2搜索引擎优化4 | < 0 | 1.7 | ||
| 硅酸 | H2SiO3. | 9.91 | 11.81 | ||
| 亚硫酸 | H2所以3. | 1.85 | 7.20 | ||
| 硫酸 | H2所以4 | 3 | 1.99 | ||
| Tellur (VI) ic酸 | H6张志贤6 | 7.6818 | 1118 | ||
| 亚碲酸 | H2张志贤3. | 6.27 | 8.43 | ||
| Triprotic酸 | |||||
| 亚砷酸 | H3.麻生太郎4 | 2.26 | 6.76 | 11.29 | |
| 磷酸 | H3.阿宝4 | 2.16 | 7.21 | 12.32 | |
| Tetraprotic酸 | |||||
| 焦磷酸 | H4P2O7 | 0.91 | 2.10 | 6.70 | 9.32 |
| 原硅酸 | H4SiO4 | 9.930. | 11.830. | 1230. | 1230. |
| 水化金属离子 | |||||
| 铝(III)离子 | 艾尔3 + | 4.85 | |||
| 钡离子 | 英航2 + | 13.4 | |||
| (2)铍离子 | 是2 + | 5.7 | |||
| (2)钙离子 | Ca2 + | 12.6 | |||
| 铬(III)离子 | Cr3 + | 3.95 | |||
| 铜(II)离子 | 英航2 + | 7.34 | |||
| 铁(III)离子 | 菲3 + | 2.17 | |||
| 铅(II)离子 | 英航2 + | 7.8 | |||
| 锂(I)离子 | 李+ | 13.8 | |||
| 镁(II)离子 | 毫克2 + | 11.4 | |||
| 锰(II)离子 | 锰2 + | 10.59 | |||
| 镍(II)离子 | 倪2 + | 9.86 | |||
| 钠离子 | Na2 + | 14.8 | |||
| 钪(III)离子 | Sc3 + | 4.61 | |||
| 锶(II)离子 | 老2 + | 13.2 | |||
| 铀(IV)离子 | U4 + | 0.68 | |||
| 钒(III)离子 | V3 + | 2.9 | |||
| 锌(II)离子 | 锌2 + | 8.96 | |||
一个酸解离常数K一个,是酸在溶液中强度的定量测量。它是平衡酸碱解离化学反应的常数。在水溶液中,酸解离平衡可以用符号表示为:
Ha + h2O = a-+ H3.O+
HA是一种解离成A的酸-,(被称为酸的共轭碱)和氢离子,氢离子与水分子结合形成水合氢离子。
化学物质为HA, A-和H3.O+当它们的浓度不随时间的推移而改变时,它们被称为处于平衡状态。的离解常数通常写成?的商平衡浓度(mol/L),记为[HA], [A .-[答案]3.O+]
K一个= (-] * [H3.O+/ [ha]*[h .2O)
除浓度最高的酸溶液外,在所有酸水溶液中,水的浓度可视为常数,可以忽略不计。这样定义就可以写得更简单
Ha = a-+ H+和K一个= (-] * [H+] / [ha]
这是常用的定义。为了许多实际目的,讨论对数常数pK更方便一个
pK一个=日志10K一个
pK值越大一个,在任何pH值下,解离程度越小,也就是说,酸越弱。
一个弱酸性有pK一个在水中的值大约在-2到12之间。
强酸有pK一个小于-2的值;强酸的解离有效地完成了,以至于未解离的酸的浓度太小而无法测量。pK一个然而,强酸的值可以用理论方法估计。
在重新排列定义K的表达式之后一个,并输入pH = -log10[H+],一个人得到
pH = pK一个+ (-/ [HA]
pH - pK一个= log [A]-] / [ha]
那么解离率为50%的溶液的pH值等于pK一个酸的。
Polyprotic酸是可以失去不止一个质子的酸。然后我们有不止一个分离常数;Ka1Ka2等. .和相似pKa1, pKa2等。
图中所有数据均适用于环境温度下的稀水溶液。
对于碱基,pk一个的值共轭基地黑洞+和黑洞22 +.
黑洞+= b + h+
的pKb对于一个基可以从pK计算一个其共轭酸值:
pKw= pK一个+ pKb
在25°C pKw是14和
pKb= 14 - pK一个
下图显示了不同酸形式(H2一个,哈-和一个2-对于两种质子酸)的二质子酸和三质子酸的水溶液在不同的pH值: